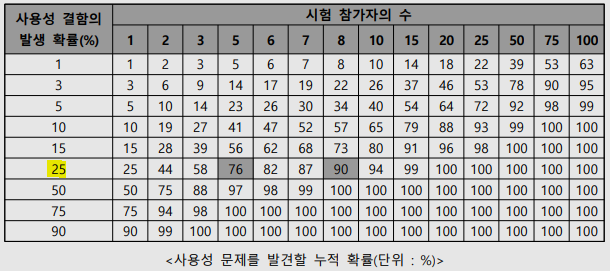
의료기기 개발 과정에서 사용성 평가는 환자 안전과 직결되는 핵심 절차입니다. 특히 IEC TR 62366-2:2016 Annex K에서 제시한 통계적 접근법은 제한된 인원으로도 효율적으로 사용성 문제를 발견할 수 있도록 돕는 지침을 제공합니다. 표에 따르면 특정 사용성 결함의 발생 확률이 25%일 경우, 5명의 참가자만으로 약 76%의 문제를 발견할 수 있으며 8명으로 확장하면 90% 이상의 문제를 파악할 수 있습니다. 그러나 8명 이상부터는 문제 발견 확률의 증가율이 점진적으로 줄어들기 때문에 비용과 시간 효율성을 고려한 최적의 참가자 수 산정이 중요합니다. 실제 의료기기 평가에서는 초기 탐색적 평가 단계에서 5~8명 정도의 소규모 사용자 그룹으로 반복적인 테스트를 수행해 주요 문제를 조기에 발견하고,..